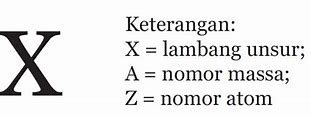
Nomor Atom Nomor Massa Karbon
Nomor Atom Dan Nomor Massa
MASIH ingatkah kamu dengan materi tentang unsur? Unsur merupakan zat murni yang tidak dapat diubah lagi menjadi zat lain dengan reaksi kimia, seperti emas, besi, perak, oksigen, dan masih banyak yang lain. Saat ini ada sekitar 105 unsur yang ditemukan di alam. Masing-masing unsur memiliki karakteristik yang berbeda-beda.
Atom-atom dari unsur yang berbeda memiliki jumlah partikel subatom yang berbeda. Semua atom dalam suatu unsur yang sama memiliki jumlah proton yang sama di dalam intinya. Jumlah proton ini unik untuk setiap unsur dan dijadikan sebagai dasar nomor atom.
Sementara nomor massa suatu atom ditentukan oleh jumlah neutron dan proton. Atom yang satu berbeda dengan atom yang lain karena punya jumlah elektron, proton, dan neutron yang berbeda. Berikut paparan lebih lanjut yang dilansir dari Buku Ilmu Pengetahuan Alam/Kementerian Pendidikan dan Kebudayaan Untuk SMP/MTs Kelas IX Semester 2 yang ditulis Siti Zubaidah dkk.
Baca juga : Partikel Penyusun Atom, Perkembangan Teori Atom, dan Pemanfaatannya
Jika dua atom punya massa atom berbeda, jari-jari kedua atom itu akan berbeda pula. Oleh sebab itu, atom H, O, dan C punya ukuran yang berbeda. Hubungan nomor atom, nomor massa, dan jumlah neutron dalam suatu atom yang netral (tidak bermuatan) dapat dituliskan dengan persamaan berikut.
Nomor atom = Jumlah proton (p) = jumlah elektron (e)
Nomor massa = Jumlah proton (p) + Jumlah neutron (n)
Baca juga : Hubungan Partikel dengan Atom dan Molekul dalam Benda
Setiap unsur dituliskan dengan lambang unsur. Pada penulisan lambang unsur, nomor atom ditulis sebagai subscript (turun) di kiri lambang unsur. Sedangkan nomor massa ditulis sebagai superscript (naik) di kiri atas lambang unsur, sebagaimana berikut.
X = lambang unsur. A = nomor massa. Z = nomor atom.
Sebagai contoh, penulisan lambang unsur litium (Li) yang punya nomor atom 3 dan nomor massa 7 yaitu .
Baca juga : Dampak Negatif Bioteknologi dan Rangkuman Pemanfaatannya
Sebagian besar unsur yang ada di alam sangat penting untuk kehidupan. Namun, ada beberapa unsur yang disebut logam berat, berbahaya bagi tubuh manusia dan lingkungan. Unsur ini tidak dapat didaur ulang dalam tubuh dan sulit untuk dikeluarkan, karena dalam tubuh kita tidak ada mekanisme yang berfungsi untuk menghilangkan unsur ini.
Logam berat mampu bertahan dalam tubuh sepanjang hayat kita. Konsentrasi logam berat dalam tubuh dapat bertambah sepanjang waktu atau dikenal dengan bioakumulasi.
Logam berat dapat menyebabkan berbagai penyakit, seperti kanker dan bahkan dapat menyebabkan kematian. Seorang wanita yang hamil juga dapat mengalami keguguran dan melahirkan bayi yang cacat akibat kandungan logam berat yang cukup tinggi dalam tubuhnya.
Baca juga : Aplikasi Bioteknologi Kesehatan: Antibiotik, Vaksin, Insulin Sintetis, Antibodi Monoklonal
Keterangan gambar: Beberapa contoh unsur (a) Merkuri (Hg), (b) Litium (Li), (c) Bromin (Br2), (d) Klorin (Cl2).
Pernahkah kamu mendengar musibah Minamata? Gejala Minamata pertama kali diidentifikasi pada 1956 di teluk Minamata, Jepang. Di teluk Minamata ini terdapat pelabuhan ikan, pabrik pupuk, dan senyawa kimia lain yang dalam prosesnya menggunakan merkuri (Hg).
Suatu ketika merkuri ini bocor dan masuk ke lautan sehingga mengontaminasi ikan dan hewan laut lain. Masyarakat sekitar yang mengkonsumsi ikan yang terkontaminasi merkuri mengalami bioakumulasi merkuri dalam tubuhnya. Bioakumulasi merkuri ini menyebabkan keterbelakangan mental, cacat lahir, buta dan tuli, serta menyebabkan kematian.
Kejadian musibah Minamata membuat perhatian warga dunia untuk lebih menjaga lingkungan dari pencemaran, khususnya pencemaran logam berat. Teluk Minamata akhirnya ditetapkan bebas merkuri pada Juli 1997 (41 tahun kemudian) dan warga sekitar dapat beraktivitas secara normal baik untuk menangkap ikan maupun berenang di laut.
Pernahkah kamu mendengar tentang arkeolog? Arkeolog merupakan ilmuwan yang mempelajari sejarah kehidupan dan kebudayaan zaman dahulu. Arkeolog mampu mengukur umur fosil yang telah ditemukan.
Tahukah kamu bagaimana cara mengukur umur fosil tersebut? Cara mengukur umur fosil adalah dengan mengidentifikasi atom karbon yang terkandung dalam fosil. Di alam terdapat tiga jenis atom karbon yaitu
Ketiga jenis atom C tersebut punya nomor atom sama yaitu nomor 6 tetapi nomor massa berbeda. Atom-atom yang demikian disebut isotop. Perbandingan jumlah ketiga isotop karbon di alam tetap.
Keterangan gambar: Isotop-isotop atom karbon-14.
Isotop karbon-14 atau dapat meluruh menjadi unsur lain dengan waktu paruh 5.730 tahun. Artinya kalau kamu punya isotop karbon-14 sebanyak 1,0 gram, setelah 5.730 tahun isotop itu tinggal 0,50 gram (separuh dari jumlah awal) karena meluruh menjadi unsur lain. Karbon-14 sangat reaktif sehingga mudah bergabung dengan oksigen menghasilkan gas karbon dioksida.
Jumlah karbon-14 pada tumbuhan dan hewan adalah tetap selama masih hidup. Karbon-14 pada tumbuhan dan hewan yang mati akan berkurang sebanding dengan waktu paruhnya.
Dengan menggunakan perbandingan jumlah karbon-14 yang masih tinggal pada tumbuhan atau hewan yang mati dengan jumlah karbon-12 yang ada di atmosfer, umur fosil tumbuhan atau fosil hewan tersebut dapat ditentukan. Nah, sekarang coba kamu hitung berapa umur fosil Dinosaurus yang awalnya memiliki 128 gram isotop karbon-14 dan sekarang tinggal 2 gram.
Tahukah kamu bahwa zat iodin (I) merupakan komponen hormon tiroksin yang diproduksi oleh kelenjar tiroid. Hormon tiroksin memiliki beberapa fungsi penting, antara lain meningkatkan laju metabolisme untuk menghasilkan energi, mengatur pertumbuhan dan perkembangan sistem saraf dan sistem rangka (otot dan tulang), serta menjaga tekanan darah.
Mengonsumsi iodin sebanyak 0,15 mg setiap hari sudah cukup untuk memenuhi kebutuhan kelenjar tiroid manusia untuk menghasilkan hormon tiroksin yang diperlukan tubuh. Kekurangan iodin dalam makanan mengakibatkan kelenjar tiroid membesar sampai ukuran abnormal atau yang dikenal dengan penyakit gondok.
Agar dapat mengatasi penyakit tersebut, saat ini iodin dalam bentuk kalium iodat (KIO3) atau kalium iodida (KI) banyak ditambahkan pada garam dapur atau yang biasa kita kenal dengan garam beriodium. (Z-2)
Pernah nggak kepikiran gimana caranya menghitung inti atom? Nah, di artikel kali ini, gue akan bahas mengenai cara mencari nomor atom dan massa atom pada inti atom.
Halo, Sobat Zenius! Saat mempelajari suatu unsur, seperti Oksigen, Hidrogen, Helium, dan Nitrogen, kita akan sering menemukan yang namanya nomor atom dan nomor massa dari unsur-unsur tersebut.
Tapi sebelum itu, elo perlu tau dulu nih apa sih yang ada di dalam suatu atom? Seperti yang kita ketahui, atom adalah satuan terkecil suatu materi. Nah, di dalam atom itu ada lagi yang namanya inti atom, terdiri dari proton dan neutron. Selain itu, atom juga dikelilingi oleh muatan negatif bernama elektron.
Kabar baiknya, ternyata kita bisa lho menghitung inti atom tersebut, dengan cara mencari nomor atom dan nomor massanya. Hmm … kira-kira nomor massa dan nomor atom itu apa ya?
Cara Mencari Nomor Atom dan Nomor Massa
Gimana cara mencari nomor atom dan nomor massa? Misalnya gini, elo ada atom Oksigen sebagai berikut.
Tentukan jumlah proton dan neutronnya!
Gimana cara mencarinya? Gampang aja, elo coba lihat lagi konsep mencari nomor atom dan nomor massa sebelumnya. Nomor atom itu hanya terdiri dari proton, yang artinya elo udah dapet nih berapa jumlah protonnya, yaitu 8. Kemudian, gimana cara mencari neutronnya? Elo cari dari nomor massa, yaitu neutron dikurangi proton, sehingga jumlah neutron adalah 16-8=8.
Lalu, gimana kalau ada ion ? Elo nggak usah bingung, meskipun atomnya berubah menjadi ion, tapi inti atomnya nggak berubah kok. Dengan kata lain, inti atom seperti proton dan neutronnya tetap.
→ p = 8, n = 16-8 = 8.
Nah, karena adalah ion, maka bisa muncul pertanyaan mengenai jumlah elektron. Patokannya adalah jumlah proton, pada atom O adalah 8. Karena, ion O adalah 2-, yang artinya kelebihan 2 elektron, sehingga elektron dari adalah 10.
Paham ya cara mencari nomor atom dan nomor massa?
Kalau elo masih penasaran sama materi ini, elo bisa langsung meluncur ke video belajar Zenius dengan klik banner di bawah ini!
Baca Juga: Materi Kimia: Struktur Atom
Pengertian Nomor Atom dan Nomor Massa
Apa yang dimaksud dengan nomor atom? Coba elo perhatikan lambang atom atau unsur berikut ini untuk mengetahui pengertian dari keduanya!
Dari lambang tersebut, bisa diambil keterangan sebagai berikut:
A = Nomor massa, yang menunjukkan jumlah proton dan neutron pada inti atom (nukleon).
Z = Nomor atom, yang menunjukkan jumlah proton pada inti atom.
Baca Juga: Inti Atom dan Partikel Penyusunnya – Materi Fisika Kelas 12
Contoh Soal Nomor Atom dan Nomor Massa
Gimana, mudah kan mencari nomor atom dan nomor massa dalam inti atom? Untuk menguji sejauh mana pemahaman elo mengenai materi di atas, gue ada beberapa contoh soal dan pembahasan yang bisa dijadikan sebagai referensi.
Jumlah nukleon pada atom molibdenum adalah ….
Pembahasan: lambang atom atau unsur adalah , di mana A adalah nomor massa yang terdiri proton dan neutron pada inti atom (neuklon). Sedangkan, Z menunjukkan jumlah proton pada inti atom.
Berapa nomor massa atom besi yang mempunyai 28 neutron?
Pembahasan: untuk mengetahui nomor massa besi, maka kita harus mengetahui dulu nomor atom (proton) dan neutron besi. Neutron udah diketahui, yaitu 28. Sedangkan, nomor atom besi (Fe) berdasarkan sistem periodik adalah 26. Nomor massa menunjukkan jumlah neutron dan proton, sehingga 28 + 26 = 54. Jadi, nomor massa atom besi yang mempunyai 28 neutron adalah 54.
Baca Juga: Materi Kimia: Rumus Massa Atom Relatif dan Aplikasinya
Biar makin mantap, Zenius punya beberapa paket belajar yang bisa lo pilih sesuai kebutuhan lo. Di sini lo nggak cuman mereview materi aja, tetapi juga ada latihan soal untuk mengukur pemahaman lo. Yuk langsung aja klik banner di bawah ini!
To search for Wikidata items by their title on a given site, use Special:ItemByTitle.
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
Nomor atom atau nomor proton (simbol Z) dari suatu unsur kimia adalah jumlah proton yang ditemukan dalam inti atom. Jumlahnya identik dengan jumlah muatan pada inti. Nomor atom secara unik mengidentifikasi elemen kimia. Dalam atom yang tidak bermuatan, nomor atom juga sama dengan jumlah elektron .
Jumlah dari nomor atom Z dan jumlah neutron N, memberikan nomor massa A dari sebuah atom. Karena proton dan neutron memiliki massa yang kira-kira sama (dan massa elektron diabaikan untuk banyak keperluan) dan energi ikatan nukleon selalu kecil dibandingkan dengan massa nukleon, ketika massa atom dari setiap atom dinyatakan dalam satuan massa atom terpadu (menjadi kuantitas yang disebut "massa isotop relatif"), bernilai kurang lebih 1% dari seluruh bilangan A.
bahasa Indonesia mempunyai rencana mengenai:
Yuk, beri rating untuk berterima kasih pada penjawab soal!
Définition, traduction, prononciation, anagramme et synonyme sur le dictionnaire libre Wiktionnaire.